Американские ученые разработали биолюминесцентный сенсор для анализа нейронной активности методом оптогенетики. В отличие от флуоресцентных аналогов новый сенсор позволяет следить за активностью целых нейронных ансамблей и не зависит от внешних источников освещения.
Оптогенетика — метод изучения работы клеток (часто нейронов) путем введения в их мембрану свет-чувствительных рецепторов. В сценарии подавления на рецептор (каналродопсин) воздействуют синим лазером, что открывает доступ притоку в клетку ионов натрия. Затем на связанный с рецептором белок (он вводится внутрь нейрона) направляют зеленый лазер и тот подсвечивает клетки, которые экспрессируют рецептор. Для активации используют рецептор меланопсин — вместо ионов натрия он открывает доступ ионам кальция, накопление которых вызывает возбуждение нейрона. Таким образом ученые могут активировать или подавлять клетки мозга, наблюдая за эффектами.
В сравнении с классической электростимуляцией оптогенетика позволяет манипулировать отдельными нейронами и проводить тонкую настройку нейронных связей. Потенциально процедура также может осуществляться неинвазивно — без имплантирования в клетку подсвечивающего белка. Однако современные инструменты оптогенетики основаны на явлении флуоресценции, что ограничивает применение метода. Так, активация флуоресцентного белка требует постоянного воздействия светом — это может приводить к феномену автофлуоресценции, когда испускать свет начинают другие, не задействованные в эксперименте клетки. Кроме того, такие зонды не позволяют изучать крупные нейронные комплексы.
В качестве альтернативы ученые из Университета Вандербильта разработали биолюминесцентный сенсор CalfluxVTN на основе синтетической люциферазы NanoLuc. Этот фермент был синтезирован ранее при изучении черноглазой креветки (Oplophorus gracilirostris) и отличается повышенной интенсивностью свечения. Для исследования люцифераза была генетически отредактирована таким образом, чтобы ее активация вызывалась ионами кальция, при этом повторного воздействия лазером для активации не требовалось. Фермент подсвечивает клетку в ответ на само возбуждение нейрона — приток ионов кальция.
На первом этапе сенсор тестировался на культуре клеток из почек человека. Затем, для проверки рабочего диапазона клеток, которые сенсор может подсвечивать, он имплантировался в нейроны гиппокампа мышей, зараженные аденоассоциированным вирусом. Активация люциферазы (после воздействия светом на рецептор) вызывалась добавлением тапсигаргина и гистамина, а в случае нейронов — всплеском ионов калия, который выступал побочным эффектом деполяризации их мембраны.
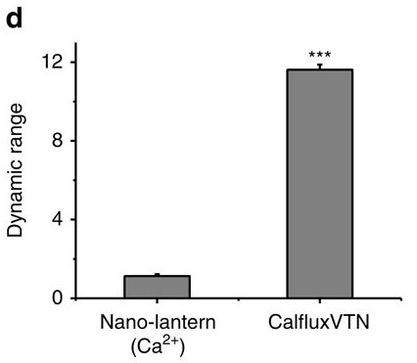
Сравнение максимальной интенсивности свечения CalfluxVTN и Nano-lantern / © Jie Yang et al.
Результаты показали, что яркость нового сенсора в 30–50 раз превышает аналог — Nano-lantern и в 100–150 раз — показатели других люминесцентных сенсоров. При этом интенсивность люминесценции напрямую зависела от уровня стимуляции свет-чувствительного рецептора. Благодаря генетическому редактированию новый датчик оказался высокоспецифичен и был невосприимчив к другим элементам деполяризации — ионам натрия, калия, магния. Испытания на нейронах подтвердили, что сенсор может использоваться на больших группах клеток: в эксперименте авторам удалось применить его к 10 процентам популяции гиппокампальных нейронов.По словам ученых, технология может стать альтернативой флуоресцентным зондам. Следующим шагом станет оценка чувствительности сенсора на отдельных клетках. Признаки такой чувствительности прослеживаются, отметили авторы.
Статья опубликована в журнале Nature Communications.
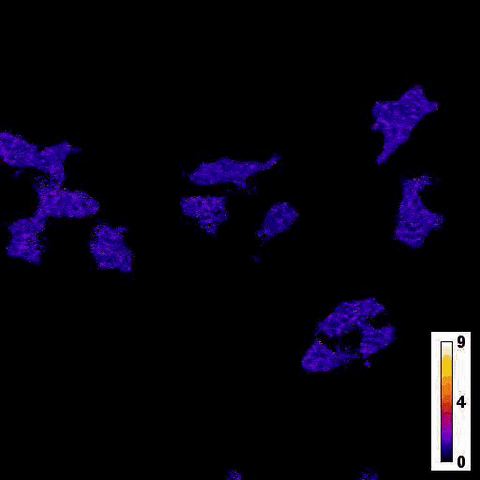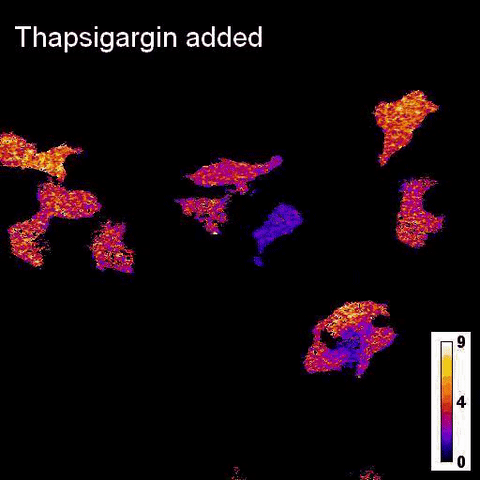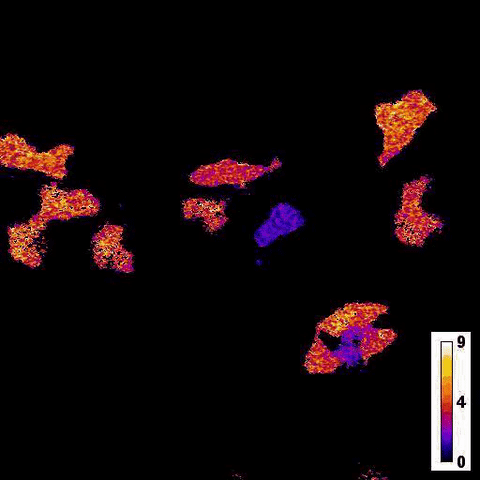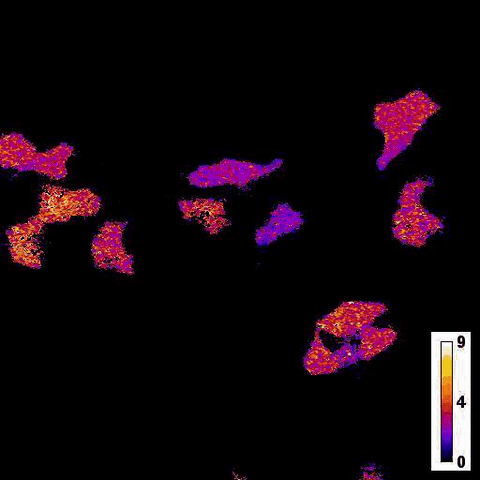
Каталитическая реакция люциферазы NanoLuc в ответ на добавление тапсигаргина в клетки печени / © Jie Yang et al.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.






Сообщить об опечатке
Текст, который будет отправлен нашим редакторам: