Яйцеклетки, выращенные в пробирке из мышиных стволовых клеток, после оплодотворения превратились в здоровых животных
Scientists have for this first time reprogrammed murine embryonic stem cells (ESCs) and induced pluripotent stem cells (iPSCs) into fully functional oocytes in the laboratory. The paper describing the technique, published today (October 17) in Nature, provides a blueprint to study theprocess of oogenesis, and paves the way to attempt a similar technique using human ESCs and iPSCs.
“This is truly a crowning achievement,” said oocyte biologist David Albertini, director of the Center for Human Reproduction in New York City, who was not involved in the work.
“It’s remarkable that . . . in vitro eggs from mouse stem cells used for reproduction,” Dieter Egli, a regenerative medicine specialist at the New York Stem Cell Foundation and Columbia University who was also not involved in the study wrote in an email to The Scientist.
In mice, oocytes are derived from primordial germ cells (PGCs), which form around day 6.5 of embryonic development. In female embryos, the PGCs make their way to what will turn into the ovary and enter meiosis to form primary oocytes, which begin to mature following puberty. Previously, Katsuhiko Hayashi of Kyushu University in Japan and colleagues reported the ability to differentiate murine ESCs and iPSCs into PGC-like cells—a process that takes about five days in vivo—that could then develop into oocytes when transplanted into adult mice. The researchers also showed that mouse-derived PGCs can be used to produce fertile oocytes in the lab.
In the present study, Hayashi and colleagues have now extended their culturing technique to encompass the entire embryonic stem cell to oocyte differentiation, which takes about 30 days in vivo.
Starting with either stem cell type, Hayashi and his colleagues first created the PGC-like cells by inducing expression of several genes and then mixed these cells with female gonadal somatic cells—which support germ cell development—to create “reconstituted ovaries” in vitro. The cells gradually lost expression of PGC markers and began to express oocyte markers.
By three weeks of growth in culture, the team observed primary oocytes in meiosis prophase I within structures that resembled secondary follicles. One of the key components at this stage, according to Albertini, was the need to add an estrogen inhibitor to get the early stage oocytes to build ovarian follicles in vitro.
The researchers then added follicle-stimulating hormone and two other factors to the medium and separated each follicle-like structure—inside which oocytes continued to grow for 11 more days—resembling full-size germinal vesicle oocytes. In the third phase, the germinal vesicle oocytes were cultured for one day in maturation culture medium to become meiosis II–arrested oocytes.
“The stumbling block for a long time that this research group finally managed to overcome is coordination of the female germ cell development with its somatic environment at every step along the way,” said Albertini.
Amander Clark, who studies germline development at the University of California, Los Angeles, and was not involved in the work, agreed. “The key seems to be the interaction with the embryonic niche cells, which surprisingly does not require transplantation.”
Altogether, the team conducted three separate culture experiments that produced 58 reconstituted ovaries and 3,198 germinal vesicle oocytes, of which 28.9 percent matured to the meiosis II stage.
“The most surprising moment was when I saw a clump of secondary follicles in the reconstituted ovary, with beautiful individual follicle structures,” wrote Hayashi in an email to The Scientist.
Testing the quality of the meiosis II–arrested oocytes, the team found that about 78 percent had the correct number of chromosomes. Then, using RNA-sequencing on pooled oocytes, the researchers observed expression in the culture-derived oocytes comparable to that of meiosis II oocytes derived from in vivo adult and newborn pup ovaries. here were 424 genes that were either up- or downregulated compared to in vivo-derived meiosis II oocytes, particularly, mitochondrial function genes, the researchers reported.
To test whether the lab-cultured meiosis II oocytes were fully functional, Hayashi’s team fertilized the oocytes with wild-type sperm in vitro, and implanted the embryos into surrogate females, which resulted in healthy pups that were slightly heavier compared to wild-type pups but that developed normally and were fertile at 11 months.
“There is variability in the quality of in vitro-generated oocytes,” noted Hayashi. “Only 3.5 percent of the two-cell embryos from the artificial oocytes gave rise to pups whereas 60 percent of two-cell embryos from [in vivo derived oocytes] did.”
Still, according to Hayashi, because the pups from in vitro generated oocytes were healthy and grew into fertile adults, some of the in vitro cultured oocytes are as potent as in vivo-derived ones. Hayashi cautioned that it is too early for any clinical use of lab-grown oocytes. “We still need to do basic research using mouse and nonhuman primates to refine the culture conditions.”
A limitation of the technique is the need for gonadal somatic cells derived from mouse, which is not possible if this technique is tried to produce human in vitro oocytes.
For Egli, the study is still a motivator for similar attempts with human stem cells—“where the real impact will be.” However, Egli cautioned that thus far, there are no data to suggest that this would work in the more-complex human system.
Albertini agreed. “Mice have relatively simple ovaries compared to humans and make pups relatively easily. The significance of this work is as a great research tool to study the molecular and cellular control of oogenesis.”
“This work is a game-changer,” wrote Clark. “However, there is still important work to do in figuring out why the in vitro eggs are not as high as quality as eggs made naturally in vivo.”
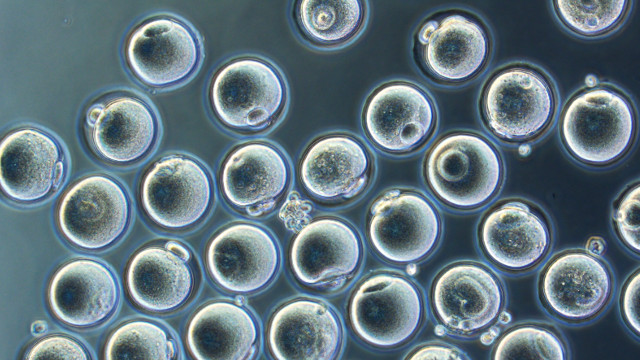
Зрелые мышиные яйцеклетки, полученные из индуцированных стволовых клеток. (Фото Katsuhiko Hayashi / Kyushu University.)
Речь в данном случае идёт об эмбриональных стволовых клетках или их искусственных аналогах – индуцированных плюрипотентных стволовых клетках. И те, и другие обладают уникальной способностью: они могу превратиться в любые из более чем двухсот типов клеток нашего тела. Собственно, в этом их функция и заключается – сформировать ткани и органы развивающегося организма. Понятно, почему ими особо интересуются медики и биотехнологи: как бы было хорошо, если бы у нас больной орган можно было просто заменить на здоровый, выращенный в пробирке.
Использовать в экспериментальных целях натуральные эмбриональные клетки, взятые из человеческих зародышей, по морально-юридическим причинам возможно далеко не всегда; так что биотехнологам пришлось создать метод, который обращает вспять развитие зрелых, дифференцированных клеток, превращая их в подобие эмбриональных стволовых. Такие клетки получили название индуцированных плюрипотентных (то есть «всемогущих») – и, согласно последним исследованиям, от своих естественных собратьев они почти не отличаются.
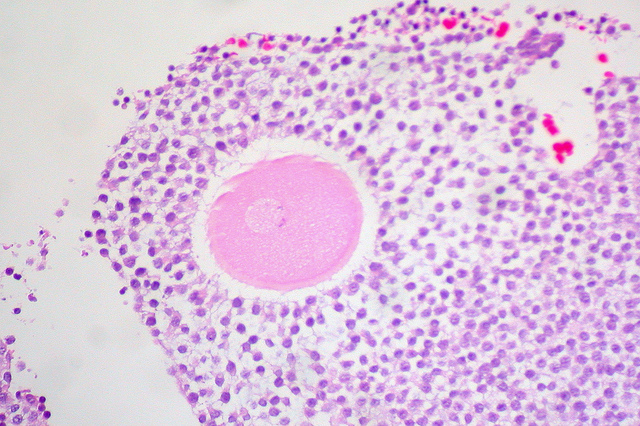
Человеческая яйцеклетка в окружении клеток яичника. (Фото Ed Uthman / Flickr.com.)
При этом, если выращивать те же нейроны из стволовых клеток научились довольно быстро, то с другими типами клеток пришлось повозиться. Например, получить женскую половую клетку – ооцит – удалось только сейчас, о чём пишут в Nature исследователи из университетов Кюсю и Киото. Развитие ооцитов само по себе достаточно непростое. У млекопитающих ещё во время эмбрионального развития из стволовых клеток появляются гоноциты – предшественники яйцеклеток, которые перебираются в формирующийся яичник. Здесь гоноциты становятся оогониями – чуть более близкими предшественниками яйцеклеток – и активно делятся. После появления женской особи на свет деления прекращаются, и в дальнейшем самка расходует тот запас предшественников половых клеток, который сформировался у неё во время внутриутробного развития.
Но оогонии – ещё не настоящие яйцеклетки. В яичнике оогонии растут и делятся, но делятся не так, как раньше. Два основных типа клеточного деления, как мы знаем, это митоз и мейоз, и в человеческом теле мейоз идёт только при созревании половых клеток (как женских, так и мужских). Основное отличие одного от другого в том, как распределяется генетический материал между дочерними клетками.
В любой нашей клетке есть два набора хромосом, отцовские и материнские, в них находятся разные варианты одних и тех же генов. При делении все хромосомы удваиваются – то есть вся генетическая информация копируется полностью – и дальше, если у нас обычное, митотическое деление, по дочерним клеткам расходятся по одной копии каждой хромосомы. С информационной точки зрения тут ничего не поменялось, дочерние клетки получили те же гены и в том же составе, какие были у материнской.
Если же клетка, например, предшественник ооцита, входит в мейоз, то новые клетки получают только половину генетической информации: здесь расходятся сами хромосомы, в обеих своих копиях. То есть, например, в одну клетку ушёл материнский вариант хромосомы I и её копия, материнский вариант хромосомы II и её копия, отцовский варианты хромосомы III и её копия и т. д. Соответственно, вторая клетка получит отцовские варианты хромосом I и II и материнский вариант хромосомы III. То есть информация не просто делится напополам – эти половины оказываются разнородны.
Потом, после такого расхождения хромосом, клетки делятся ещё раз обычным митотическим способом. Как мы только что сказали, после первого деления в дочерние клетки хромосомы уходят вместе со своими сделанными заранее копиями, и вот во втором делении расходятся уже эти самые копии. В результате из одной клетки с двойным (диплоидным) набором хромосом получается четыре с одинарным (гаплоидным) набором. При оплодотворении одна гаплоидная половая клетка сливается с другой гаплоидной, и получается диплоидный зародыш.
Как видим, если нам нужно «вручную» получить яйцеклетки из стволовых клеток, то мы должны в лабораторных условиях превратить стволовую клетку в гоноцит (напомним – первый предшественник яйцеклетки), а потом помочь гоноциту вырасти в оогоний, а оогоний провести через вышеописанное сложное деление-мейоз.
Несколько лет назад Кацухико Хаяси (Katsuhiko Hayashi) и его коллеги опубликовали в Science статью, в которой рассказывали, что им удалось за пять дней довести мышиные стволовые клетки (как эмбриональные, так и искусственные индуцированные) до состояния гоноцита, после чего их пересаживали мышам, в чьих яичниках предшественники половых клеток успешно дозревали до нормальных яйцеклеток.
В следующих экспериментах было решено воссоздать в пробирке уже весь процесс созревания до конца. Теперь к гоноцитам, созревшим из стволовых клеток, добавляли компаньонов – клетки яичника, которые как раз помогают созреванию яйцеклеток. В присутствии клеток яичника гоноциты становились всё менее похожи на сами себя и всё более – на яйцеклетки.
Постепенно клетки, растущие в лабораторной культуре, формировали нечто похожее на фолликул яичника – пузырёк, образованный вспомогательными клетками яичника и с созревающей яйцеклеткой внутри. На этом этапе использовали гормональные сигналы: во-первых, подавляли реакцию клеток на эстроген, во-вторых, добавляли в питательную среду фолликулостимулирующий гормон и ещё некоторые белковые факторы, управляющие созреванием яйцеклеток.
По сути дела, всё сводилось к тому, чтобы помочь клеткам самоорганизоваться в какое-то подобие яичника, для чего и нужно было в определённые моменты менять молекулярные сигналы в культуральной среде. Оказалось, что такое подобие яичника вполне годится для созревания яйцеклеток – в результате до зрелого состояния удалось довести почти треть исходных предшественников яйцеклеток.
Авторы работы проверили, насколько такие искусственные яйцеклетки похожи на естественные, нет ли в них каких-либо дефектов, правильно ли у них распределились хромосомы при делении и т. д. С хромосомами оказалось всё в порядке – в 78% случаев они распределились во время деления так, как надо. Активность генов у искусственных яйцеклеток тоже была такой же, как у естественных.
Ну и, наконец, главный тест на функциональность искусственные яйцеклетки тоже прошли: после того, как их оплодотворяли сперматозоидами, и получившиеся эмбрионы пересаживали самкам мышей, у тех рождались вполне здоровые мышата. Единственное их отличие от мышат, полученных естественным путём, было в том, что «искусственные» были несколько тяжелее; впрочем, в дальнейшем «искусственные» мыши нормально росли и развивались, и к 11 месяцу из них получались взрослые плодовитые животные.
Конечно, выращенные полностью в пробирке яйцеклетки были менее эффективны, чем те, которые формировались в живом организме: только 3,5% искусственных яйцеклеток после оплодотворения дошли, так сказать, до стадии новорождённого мышонка, тогда как обычные яйцеклетки, взятые у мышей для экстракорпорального оплодотворения и потом в оплодотворённом виде возвращённые самкам, доходили до «финиша» в 60% случаев. Однако в данном случае важен сам факт, что нет ничего невозможного в том, чтобы получить из клеточно-стволового «сырья» вполне нормальную яйцеклетку, которая потом превратится в здоровый взрослый организм.
Конечно, при известной доле фантазии можно представить, как искусственная яйцеклетка оплодотворяется искусственным сперматозоидом (а такие тоже уже научились получать) и потом растёт в каком-то биотехнологическом аналоге матки. Но если так и будет, то в не очень близком будущем; пока же с помощью этой технологии можно подробно изучать, как вообще организм контролирует созревание яйцеклеток и какие клеточно-молекулярные дефекты лежат в основе разных вариантов бесплодия.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.







Сообщить об опечатке
Текст, который будет отправлен нашим редакторам: